Задание 1 «Десять порошков»
В десяти пронумерованных стаканах выданы порошки следующих веществ: медь, оксид меди(II), древесный уголь, красный фосфор, сера, железо, хлорид натрия, сахар, мел, малахит (оснóвный карбонат меди(II)). Ученики исследовали свойства выданных порошкообразных веществ, результаты своих наблюдений представили в таблице.
| Номер стакана | Цвет исследуемого вещества | «Поведение» порошка при помещении его в стакан с водой | Изменения, наблюдаемые при нагревании исследуемого порошкав ложечке с помощью спиртовки |
1 | белый | тонет в воде, постепенно растворяется | практически не изменяется |
2 | белый | тонет в воде, постепенно растворяется | плавится, темнеет, постепенно обугливается |
3 | белый | тонет в воде, не растворяется | практически не изменяется |
4 | жёлтый | частички плавают на поверхности воды, не растворяются | плавится, горит голубоватым пламенем |
5 | красный | тонет в воде, не растворяется | постепенно чернеет |
6 | тёмно-красный | тонет в воде, не растворяется | горит ярким белым пламенем |
7 | зелёный | тонет в воде, не растворяется | постепенно чернеет |
8 | тёмно-серый | тонет в воде, не растворяется | темнеет, частички в пламени раскаляются |
9 | чёрный | частички плавают на поверхности воды, не растворяются | начинает тлеть |
10 | чёрный | тонет в воде, не растворяется | практически не изменяется |
- Определите, в каком по номеру стакане находится каждое из веществ, выданных для исследования. Ответ обоснуйте.
- Какие из выданных веществ реагируют с соляной кислотой с выделением газа? Составьте соответствующие уравнения реакций.
- Известно, что плотность веществ, находящихся в стаканах № 4 и № 9, больше плотности воды, т. е. эти вещества должны тонуть в воде. Однако порошки этих веществ плавают на поверхности воды. Предложите возможное объяснение этому факту.
- Известно, что три выданных вещества проводят электрический ток. Какие это вещества? Раствор какого вещества проводит электрический ток?
Решение
1. В стакане № 1 находится хлорид натрия. Белый цвет, растворяется в воде,практически не изменяется на воздухе при нагревании.
№ 2 – сахар; белый цвет, растворяется в воде, плавится и постепенно
обугливается при нагревании.
№ 3 – мел; белый цвет, не растворяется в воде.
№ 4 – сера; жёлтый цвет, характерное горение.
№ 5 – медь; красный цвет; появление чёрной окраски при нагревании на воздухе за счёт образования оксида меди(II).
№ 6 – красный фосфор; тёмно-красный цвет; характерное горение.
№ 7 – малахит; зелёный цвет; появление чёрной окраски при термическом разложении за счёт образования оксида меди(II).
№ 8 – железо; тёмно-серый цвет; потемнение при нагревании.
№ 9 – древесный уголь; чёрный цвет; тлеет при нагревании на воздухе.
№ 10 – оксид меди(II); чёрный цвет; отсутствие изменений при нагревании.
По 0,5 балла за каждое верное определение и разумное обоснование.
Максимум – 5 баллов.
2. Газообразные вещества выделяются при взаимодействии соляной кислоты с мелом, малахитом и железом:
- CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
- (CuOH)2CO3 + 4HCl = 2CuCl2 + CO2↑ + 3H2O
- Fe + 2HCl = FeCl2 + H2↑
По 1 баллу за каждое уравнение
3. В стаканах № 4 и № 9 находятся соответственно порошки серы и древесного угля. Частички древесного угля пронизаны капиллярами, заполненными воздухом, таким образом, их средняя плотность оказывается меньше 1 г/мл. К тому же, поверхность угля, как и поверхность серы, не смачивается водой, т. е. является гидрофобной. Мелкие частички этих веществ удерживаются на поверхности воды силой поверхностного натяжения.
1 балл
4. Электрический ток проводят медь, железо и уголь.
Раствор хлорида натрия проводит электрический ток, т. к. NaCl – электролит.
1 балл
Всего 10 баллов.
Задание 2 «Вывод формулы органического вещества»
Органическое соединение А содержит 39,73 % углерода и 7,28 % водорода по массе. Определите молекулярную формулу вещества А и установите его структурную формулу, если известно, что в его состав входит четвертичный атом углерода, а плотность паров по воздуху равна 5,2. Назовите органическое соединение А по систематической номенклатуре. Предложите способ получения А.
Решение
1) Т.к. сумма массовых долей не равна 100 %, следовательно, в молекуле ещё есть какой-то остаток, содержание которого равно: 100 – 39,73 – 7,28 = 52,99 %.
Молярная масса вещества: M(A) = Dвозд∙Mвозд = 5,2 ∙ 29 = 151 г/моль.
Число атомов водорода в молекуле A: 151 ∙ 0,0728/1 = 11.
Число атомов углерода в молекуле A: 151 ∙ 0,3973/12 = 5.
Молярная масса остатка равна 151 × 0,5299 = 80 г/моль, что соответствует одному атому брома, следовательно, молекулярная формула вещества А – C5H11Br.
2) В состав А входит четвертичный атом углерода, поэтому А имеет следующую структуру:
3) Способ получения А:
f2.2
Система оценивания:
| 1) Определение количества атомов углерода | 1 балл |
Определение количества атомов водорода | 1 балл |
Определение брома | 2 балла |
Молекулярная формула | 1 балл |
| 2) Структура | 2 балла |
Название | 1 балл |
| 3) Уравнение реакции получения | 2 балла |
Всего 10 баллов. |
Задание 3 «Три углеводорода»
Массовая доля углерода в трёх углеводородах составляет 85,7 %. Установите молекулярные формулы этих углеводородов, если плотность их по воздуху составляет 0,97; 1,43; 1,93. Приведите структурные формулы изомеров этих углеводородов и назовите их в соответствии с правилами международной номенклатуры.
Решение
а) Определение молярных масс углеводородов: М = Dвозд.(СxHy)∙29;
- M1 = 0,97∙29 = 28 г/моль;
- M2 =1,45∙29 = 42 г/моль;
- M3 = 1,93∙29 = 56 г/моль.
б) Определение простейшей формулы искомых углеводородов: 100 г вещества СxНy содержат 85,7 г углерода и 14,3 г водорода. Соотношение количества вещества углерода и водорода для искомых углеводородов составляет:
f3.1
Следовательно, простейшая формула искомых углеводородов СН2;
М(СН2)= 14 г/моль.
в) Определение молекулярных формул искомых углеводородов и приведение структурных формул их изомеров:
1-й углеводород
28 : 14 = 2; n = 2 ⇒ С2Н4 — этилен. Изомеров не имеет.
2-й углеводород
42 : 14 = 3; n = 3 ⇒ С3Н6
Изомеры С3Н6:
CH2=СН–СН3 — пропен
Циклопропан
— циклопропан3-й углеводород
56 : 14 = 4; n = 4 ⇒ С4Н8
Изомеры: СН3 – СН2 – СН = СН2 — бутен-1
цис-бутен-2
— цис-бутен-2транс-бутен-2
— транс-бутен-2СН3 – С(CН3) = СН2 — метилпропен
циклобутан
— циклобутанметилциклопропан
— метилциклопропанКритерии оценивания
Определение простейшей формулы углеводородов. 1 балл
Определение молекулярных формул углеводородов и приведение структурных формул их изомеров:
- 1-й углеводород – 2 балла (1 балл за молекулярную формулу и 1 балл за структуру этилена)
- 2-й углеводород – 2 балла (1 балл за молекулярную формулу и по 0,5 балла за каждую структуру)
- 3-й углеводород – 5 баллов (1 балл за молекулярную формулу, по 0,5 балла за каждую структуру и 1 балл дополнительно, если учтена цис-трансизомерия).
(Если молекулярные формулы правильно определены без использования простейшей формулы, то 1 балл за простейшую формулу добавляется к результату.)
Всего 10 баллов.
Задание 4 «Превращения неметалла»
1) Выберите подходящий неметалл и осуществите для него превращения:
простое вещество → X → водородное соединение → высший оксид → простое вещество → соль
2) Напишите уравнения соответствующих реакций.
Решение
1) Подходят кремний и фосфор.
Цепочка для кремния.
Si → Mg2Si → SiH4 → SiO2 → Si → Na2SiO3
2) Уравнения реакций:
- Si + 2Mg = Mg2Si
- Mg2Si + 4HCl = SiH4↑ + 2MgCl2
- SiH4 + 2O2 = SiO2 + 2H2O
- SiO2 + C = Si + CO2
- Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Каждое уравнение реакции – 2 балла.
Всего 10 баллов.
Задание 5 «Правые части с коэффициентами»
Восстановите левую часть уравнений:
- …. + …. + …. = Na2SO4 + 2Ag↓ + 2HNO3
- …. = Na2S + 3Na2SO4
- …. + …. + …. = 3Na2SO4 + 2MnO2↓ + 2KOH
- …. + …. = POCl3 + SOCl2
- …. +…. +….
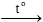 2H2SO4
2H2SO4
Решение
- Na2SO3 + H2O + 2AgNO3 = Na2SO4 + 2Ag↓ + 2HNO3
- 4Na2SO3 = Na2S + 3Na2SO4
- 3Na2SO3+ H2O + 2KMnO4 = 3Na2SO4 + 2MnO2↓ + 2KOH
- SO2 + PCl5 = POCl3 + SOCl2
- 2SO2 + 2H2O + O2
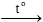 2H2SO4
2H2SO4
По 2 балла за уравнение.
Всего 10 баллов.
Задание 6 «Волшебный порошок»
Разбирая реактивы в лаборатории, юный химик нашёл неподписанную банку с белым порошком без запаха. Для исследования его свойств, юный химик аккуратно взвесил 10,00 граммов и разделил их ровно на 5 частей, с каждой из частей он провёл следующие опыты:
Номер опыта | Ход эксперимента | Наблюдения |
1 | Добавил в воду, а затем прилил несколько капель раствора лакмуса | Хорошо растворим в воде. Раствор окрасился в красный цвет |
2 | Растворил в воде. Затем добавил избыток карбоната калия | Бурное выделение газа |
3 | Аккуратно внёс часть навески в пламя горелки | Пламя горелки окрасилось в фиолетовый цвет |
4 | Растворил в воде. Затем добавил избыток хлорида бария | Выпало 3,43 г белого осадка, нерастворимого в кислотах и щелочах |
5 | Растворил в воде. После этого добавил избыток гидроксида калия | Пробирка нагрелась. Видимых признаков реакции не наблюдалось |
- Определите состав белого порошка. Ответ подтвердите расчётом.
- Для опытов 2, 4, 5 приведите соответствующее уравнение реакции.
- Что произойдёт при нагревании белого порошка? Приведите уравнение реакции.
Решение
1. Окрашивание пламени горелки в фиолетовый цвет говорит о том, что искомый порошок – соль калия. Выпадение белого осадка с избытком хлорида бария – качественная реакция на сульфат-ион. Но сульфат калия (K2SO4) имеет нейтральную среду (соль образована сильным основанием и сильной кислотой), а согласно опыту № 1 лакмус окрашивает раствор соли в красный цвет, что говорит о кислой реакции.
Следовательно, искомая соль – гидросульфат калия, KHSO4. Проверим это расчётом:
KHSO4 + BaCl2 → BaSO4↓ + HCl + KCl
т. к. исходную навеску в 10,00 г юный химик разделил на пять равных частей, значит в реакцию вступило 2,00 г соли:
ν(KHSO4) = ν(BaSO4) = 2г : 136г/моль = 0,0147 моль
m(BaSO4 ) = 0,0147 моль ∙ 233 г/моль = 3, 43 г.
Полученная масса сульфата бария совпадает с результатами эксперимента, следовательно белый порошок – действительно KHSO4.
Уравнения реакций:
- 2KHSO4 + K2CO3 → 2K2SO4 + CO2↑ + H2O
- KHSO4 + BaCl2 → BaSO4↓ + HCl + KCl
- KHSO4 + KOH → K2SO4 + H2O
Уравнение реакции разложения:
2KHSO4 ![]()
Система оценивания:
| 1) Вывод о присутствии ионов калия | 1 балл |
| Вывод о присутствии сульфат-ионов | 1 балл |
| Расчёт | 2 балла |
| Формула соли | 1 балл |
| 2) 3 уравнения по 1 баллу | 3 балла |
| 3) Уравнение реакции разложения | 2 балла |
| Всего | 10 баллов |
набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не
учитывается.
