Задание 1 (10 баллов) «Реакции кислорода»
Приведите примеры реакций с участием кислорода, в результате которых образуются:
- а) вода и кислотный оксид;
- б) вода и простое вещество;
- в) кислотный и основный оксиды;
- г) два кислотных оксида;
- д) основание.
Напишите уравнения реакций.
Решение
- а) CH4 + 2O2 = CO2 + 2H2O;
- б) 4NH3 + 3O2 = 2N2 + 6H2O;
- в) 2CuS + 3O2 = 2CuO + 2SO2;
- г) CS2 + 3O2 = CO2 + 2SO2;
- д) 2NaH + O2 = 2NaOH.
Принимаются любые другие реакции, удовлетворяющие условию.
Критерии оценивания
- Каждое уравнение – по 2 балла (1 балл, если не уравнено).
Всего за задачу – 10 баллов.
Задание 2 (10 баллов) «Химический текст»
В состав большинства органических веществ помимо углерода входят кислород и водород. Доказать наличие углерода в органических веществах просто: при сильном нагревании без доступа воздуха они разлагаются, образуя уголь.
Однако, в результате простого нагревания ни кислород, ни азот, ни водород в свободном виде не выделяются. Некоторые органические вещества в смеси с серой при нагревании разлагаются с образованием сероводорода – газа, имеющего неприятный запах тухлых яиц. При нагревании без доступа воздуха сероводород разлагается, образуя серу и водород. В атмосфере фтора сероводород сгорает, образуя фторид серы(VI) и фтороводород (соединение водорода с фтором).
- Выпишите отдельно упомянутые в тексте:
- а) названия и символы химических элементов;
- б) названия и формулы простых веществ.
- Запишите уравнения реакций сгорания сероводорода во фторе и разложения сероводорода.
Решение
- Упомянутые в тексте названия и символы химических элементов:
- (а) элементы: углерод С, кислород О, водород Н.
- (б) простые вещества: уголь С, кислород О2, водород Н2, азот N2, сера S (или S8), фтор F2.
- H2S + 4F2 = SF6 + 2HF, H2S = H2 + S.
Критерии оценивания
- По 0,5 балла начисляется за каждое правильное название и каждую формулу простого вещества или элемента. В пункте б) оценка ставится за любые пять простых веществ из шести, всего – 8 баллов.
- По 1 баллу начисляется за каждое уравнение реакции, всего – 2 балла.
Всего за задачу – 10 баллов.
Задание 3 (10 баллов) «Доли водорода»
Водород образует химические соединения со многими неметаллами и некоторыми металлами. В двух бинарных соединениях A и B массовая доля водорода – одна и та же: 1/17, при этом, число атомов водорода в соединении A составляет 1/2 от общего числа атомов, а в соединении В – 2/3 от общего числа атомов.
- Установите молекулярные формулы соединений A и B. Ответ подтвердите расчётом.
- Напишите уравнение реакции между соединениями A и B, если известно, что в результате образуются простое вещество и бинарное соединение, в котором массовая доля водорода равна 1/9.
Решение
- В соединении A на один атом водорода массой 1 а.е.м. приходится один атом другого элемента массой 16 а.е.м., этот элемент – кислород. Простейшая формула вещества A – HO, молекулярная – H2O2.
В соединении B атомов водорода в 2 раза больше, чем атомов другого элемента. На два атома H массой 2 а.е.м. приходится один атом элемента массой 2∙16 = 32 а.е.м., это – сера. Вещество B – сероводород, H2S.
- Массовая доля водорода равна 1/9 в воде. Простое вещество, которое может образоваться в результате реакции между H2O2 и H2S – сера. Уравнение реакции: H2O2 + H2S = S + 2H2O.
Критерии оценивания
- Формулы A и B с расчётом – по 4 балла (без расчёта – 0 баллов), всего – 8 баллов.
- Уравнение реакции – 2 балла (если не уравнено, но правильные продукты – 1 балл).
Всего за задачу – 10 баллов.
Задание 4 (10 баллов) «Трёхатомные газы»
При действии на воздух электрического разряда образовались два газа, каждый из которых состоит из трёхатомных молекул.
- Назовите эти газы, составьте их химические формулы.
- Напишите уравнения реакций их взаимодействия а) с углем, б) с алюминием, зная, что ни одна из этих реакций не относится к реакциям соединения, а в продуктах каждой реакции есть одно простое вещество.
- Во время какого природного явления эти газы образуются в естественных условиях?
Решение
- В состав воздуха входят азот и кислород. Образующиеся из них трёхатомные газы, – озон О3 и оксид азота(IV) NO2.
- Уравнения реакций:
- 2C + 2O3 = 2CO2 + O2,
- 2C + 2NO2 = 2CO2 + N2,
- 2Al + 3O3 = Al2O3 + 3O2,
- 6NO2 + 8Al = 4Al2O3 + 3N2
- Газы образуются во время грозы.
Критерии оценивания
- По 0,25 балла за каждое название и каждую формулу вещества, всего – 1 балл.
- По 2 балла за каждое уравнение (по 1 баллу, если указаны правильные продукты, но не уравнено), всего – 8 баллов.
- 1 балл.
Всего за задачу – 10 баллов.
Задание 5 (10 баллов) «Опыты Лавуазье»
При нагревании жидкого простого вещества А до 300 °C с газообразным простым веществом Б образуется сложное вещество В красного цвета. При нагревании выше 340 °C вещество В разлагается с образованием веществ А и Б.
Эти реакции лежали в основе исторических опытов, проделанных французским химиком Антуаном Лавуазье.
- Какие вещества зашифрованы буквами А, Б и В?
- Запишите уравнения реакций, описанных в задании.
- Какое открытие сделал А. Лавуазье, проводя эксперименты с веществом А?
Решение
- А – Hg, Б – O2, В – HgO.
- Уравнения реакций:
- 2Hg + O2 = 2HgO
- 2HgO = 2Hg + O2
- На основе проделанных опытов со ртутью А. Лавуазье доказал количественный состав атмосферного воздуха. Наряду с другими учёными (К. Шееле, Дж. Пристли) он получил кислород и установил его природу.
Критерии оценивания
- По 2 балла за каждое вещество, всего – 6 баллов.
- По 1 баллу за каждую реакцию, всего – 2 балла.
- 2 балла.
Всего за задачу – 10 баллов.
Задание 6 (10 баллов) «Простой эксперимент»
В пробирку поместили порошкообразное вещество М зелёного цвета (см. рис. 6.1) и нагрели. В результате реакции вещество М превратилось в твёрдое вещество X чёрного цвета. На стенках пробирки сконденсировались капли бесцветной прозрачной жидкости Y. Выделился бесцветный газ Z, который пропустили в стакан с известковой водой, при этом наблюдалось её помутнение.
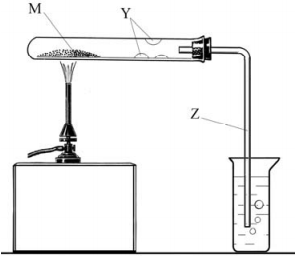 Рисунок 6.1
Рисунок 6.1Затем порошок вещества X перенесли в трубку и нагрели (см. рис. 6.2). В трубку пропустили ток метана (CH4, метан — бесцветный газ). В результате реакции вещество X превратилось в металл красного цвета. На стенках трубки сконденсировались капли бесцветной прозрачной жидкости Y. Из трубки выделился бесцветный газ Z, который пропустили в стакан с известковой водой, при этом наблюдалось её помутнение.
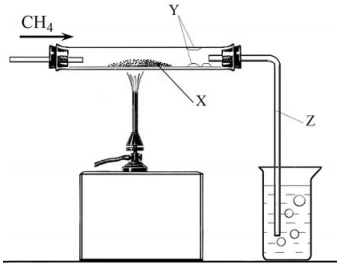 Рисунок 6.2
Рисунок 6.2- Определите вещества X, Y и Z, которые образовались при разложении вещества M.
- Предложите возможный состав вещества М, приведите соответствующее уравнение реакции его разложения при нагревании.
- Проводя реакцию термического разложения вещества М, пробирку закрепляют с небольшим наклоном в сторону отверстия (см. рис. 1). С какой целью это делают?
- Какая реакция протекала при пропускании метана над нагретым порошком X? Составьте уравнение данной реакции.
- Как можно металлический порошок красного цвета, полученный во втором опыте, снова превратить в вещество X? Напишите соответствующее уравнение реакции.
Решение и критерии оценивания
1. X – CuO; Y – H2O; Z – CO2.
По 1 баллу за каждое вещество.
2. М – Cu2(OH)2CO3 (оснóвный карбонат меди(II))
Cu2(OH)2CO3 ![]()
1 балл за состав, 1 балл за уравнение.
3. Одним из продуктов разложения вещества М является вода, пары которой конденсируются на внутренних стенках пробирки. Из-за небольшого наклона в сторону отверстия капли конденсата оттекают от зоны реакции, где стекло сильно нагрето. В противном случае капли воды попадут на нагретое стекло, и пробирка лопнет.
1 балл
4. CH4 + 4CuO ![]()
3 балла
5. Порошок красного цвета — металлическая медь. Для её превращения в оксид следует провести реакцию с кислородом: 2Cu + O2 = 2CuO
1 балл
Всего за задачу – 10 баллов.
Максимальное количество баллов за работу – 50.
В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается.
